Цель – исследование характеристик кистевого теппинга в норме и влияния субклинической тревоги на его параметры при постинсультной эпилепсии у взрослых.
Материал и методы. Обследованы 140 человек в возрасте от 22 до 55 лет. Общая выборка была разделена на 3 группы наблюдения: первая (I) группа – здоровые добровольцы; вторая (II) группа – больные с постинсультной лобнодолевой эпилепсией; третья (III) группа – больные с постинсультной височнодолевой эпилепсией. Каждая группа была разбита на две подгруппы: подгруппа Iа (33 человека) – здоровые добровольцы, не имеющие достоверно выраженных симптомов тревоги; подгруппа Iб (27 человек) – здоровые добровольцы с субклинически выраженной тревогой; подгруппа IIа (20 человек) – больные с постинсультной лобно-долевой эпилепсией, не имеющие достоверно выраженных симптомов тревоги; подгруппа IIб (20 человек) – больные с постинсультной лобно-долевой эпилепсией с субклинически выраженной тревогой; подгруппа IIIа (19 человек) – больные с постинсультной височно-долевой эпилепсией, не имеющие достоверно выраженных симптомов тревоги; подгруппа IIIб (21 человек) – больные с постинсультной височно-долевой эпилепсией с субклинически выраженной тревогой. Параметры кистевого теппинга исследованы с использованием модифицированной авторской программы «Способ воздействия на индивидуальный ритм человека посредством экзогенной ритмической стимуляции».
Результаты. Найдено ускорение индивидуального ритма при наличии субклинически выраженной тревоги как у здоровых добровольцев (с 1,13 Гц до 1,53 Гц), так и у больных с постинсультной лобно-долевой и височно-долевой эпилепсией (с 2,07 Гц до 3, 45 Гц и с 1,83 Гц до 2,82 Гц соответственно). Коэффициент ускорения индивидуального ритма у больных с постинсультной лобно-долевой и височно-долевой эпилепсиями выше, чем у здоровых добровольцев (1,66 и 1,54 против 1,35 соответственно).
Заключение. Влияние тревоги на параметры кистевого теппинга больше у больных с постинсультной эпилепсией по сравнению со здоровыми добровольцами.
ВВЕДЕНИЕ
Важной проблемой эпилептологии является безопасность, переносимость лечения, возникновение нежелательных побочных реакций (НПР) противоэпилептических препаратов (ПЭП). Часто возникновение НПР генетически детерминировано [1] и может значительно нарушать качество жизни пациентов, тем самым нивелируя положительный эффект от лечения (в том числе и оперативного) структурных фокальных эпилепсий, а такие НПР, как депрессия и тревожность (страх и ожидание приступа), могут явиться причиной аггравации эпилептических приступов [2–5].
Сохранение приступов на фоне длительного приема ПЭП при монои политерапии и после проведения хирургической коррекции структурных эпилепсий существенно снижает качество жизни пациентов с эпилепсией: они испытывают сложности при трудоустройстве; зачастую не могут работать по специальности или получить желаемую специальность; отмечают трудовую дезадаптацию. Кроме того, у пациентов с эпилепсией развиваются коморбидные непсихотические психиатрические расстройства [6]. Это явилось поводом к изменению методологических подходов к терапии рассматриваемой патологии и внедрению новой дефиниции – болезнь-модифицирующей терапии, которая направлена в первую очередь на снижение темпов прогрессирования заболевания. Болезнь-модифицирующая терапия подразумевает под собой как фармакологические, так и нефармакологические подходы [7,8].
Учитывая данный факт, во всем мире активно ведется разработка эффективных методов немедикаментозного болезнь-модифицирующего лечения эпилепсии. К таким методам относятся психотерапевтические методики [9,10]. В настоящее время принято выделять три основные категории психотерапевтических методик, используемых в эпилептологии: поощрение/наказание; самоконтроль; биологическая обратная связь (БОС). Категория поощрение/наказание и категория самоконтроля применяются при самоиндуцируемых приступах и так называемых рефлекторных приступах, а также при эпилептических приступах, усиливающихся под воздействием эмоциональных факторов. БОС относится к нефармакологическим методам лечения эпилепсии с объективной регистрацией, усилением и «обратным возвратом» пациенту физиологической информации. В основу метода БОС положен принцип самоидентификации данных электроэнцефалографии [9], однако в последние годы предложены и другие варианты БОС [10].
Настоящая работа, посвященная кистевому теппингу, призвана заложить основы в теоретическую базу для разработки нового направления немедикаментозной болезнь-модифицирующей терапии структурной эпилепсии, реализующегося через формирование новой доминирующей «здоровой системы», основанного на отвлечении и переключении внимания больного. Данное направление относится к категории психотерапевтических методов, основанных на принципе БОС, и опирается на классическую теорию Г.Н.Крыжановского [11] о строении и разрушении патологических систем при использовании метода кистевого теппинга [10].
В качестве модели фокальной структурной эпилепсии у взрослых людей для оценки возможности применения кистевого теппинга с практической точки зрения наибольший интерес представляют постинсультные и постоперационные эпилепсии (после резекционного хирургического лечения фокальных структурных эпилепсий). Это наиболее распространенные формы эпилепсии у пациентов среднего (зрелого) и пожилого возрастов, которые сопряжены с коморбидными персонализированными расстройствами [12]. При этом триггером фокальных эпилептических приступов и/или их вторичной билатеральной трансформации зачастую является высокий уровень тревожности после перенесенного инсульта и оперативного вмешательства [13].
Цель – изучение характеристик кистевого теппинга в норме и влияния субклинической тревоги на его параметры при постинсультной эпилепсии у взрослых.
МАТЕРИАЛ И МЕТОДЫ
Тип исследования: обсервационное, рандомизированное, сравнительное, поперечное (рис. 1).
Исследование выполнено на базах: неврологического центра эпилептологии, нейрогенетики и исследования мозга Университетской клиники; кафедры нервных болезней с курсом медицинской реабилитации постдипломного образования; кафедры медицинской генетики и клинической нейрофизиологии института постдипломного образования, а также в рамках договора о научном сотрудничестве с Национальным медицинским исследовательским центром психиатрии и неврологии имени В. М. Бехтерева (отделение персонализированной психиатрии и неврологии), Санкт-Петербург.
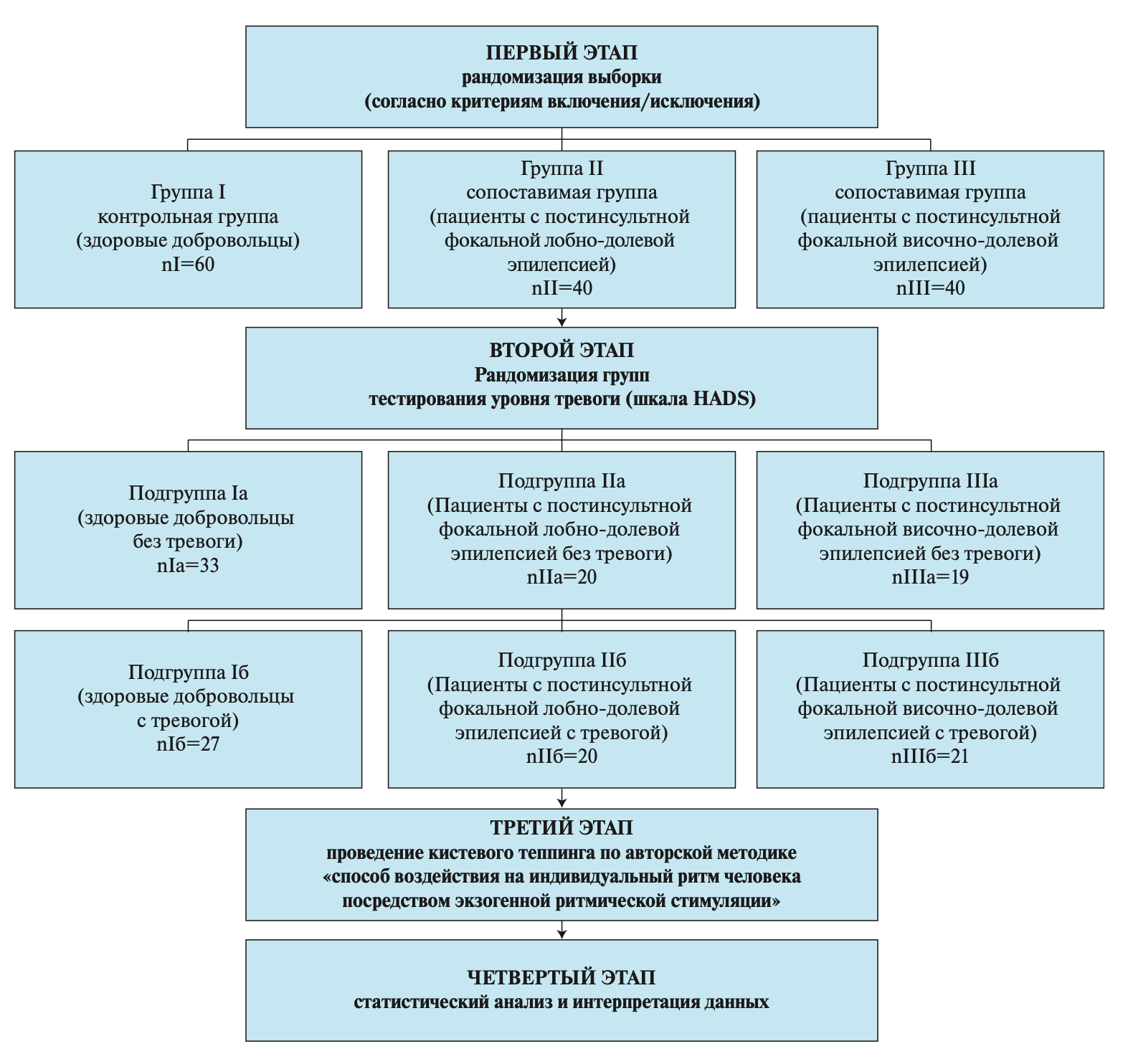
Рисунок 1. Дизайн исследования.
Распределение по группам
Всего в исследовании приняли участие 140 человек в возрасте от 22 до 55 лет. Общая выборка была разделена на 3 группы наблюдения: первая (I) группа (контрольная) – здоровые добровольцы (nI=60 человек; средний возраст 33,11±10,24 года); вторая (II) группа (сопоставимая) – больные с постинсультной лобно-долевой эпилепсией (nII=40 человек); третья (III) группа (сопоставимая) – больные с височно-долевой постинсультной эпилепсией (nIII=40 человек). Каждая группа была разбита на две подгруппы: подгруппа Iа (nIа=33 человека; средний возраст – 33,69±12,06 года) – здоровые добровольцы, не имеющие достоверно выраженных симптомов тревоги (0–7 баллов по госпитальной шкале тревоги и депрессии); подгруппа Iб (nIб=27 человек; средний возраст – 32,4±11,46 года) – здоровые добровольцы с субклинически выраженной тревогой (8–10 баллов по госпитальной шкале тревоги и депрессии); подгруппа IIа (nIIа=20 человек; средний возраст – 50±6,9 года) – больные с лобно-долевой постинсультной эпилепсией, не имеющие достоверно выраженных симптомов тревоги (0–7 баллов по госпитальной шкале тревоги и депрессии); подгруппа IIб (nIIб=20 человек; средний возраст – 46±10 лет) – больные с лобно-долевой постинсультной эпилепсией с субклинически выраженной тревогой (8–10 баллов по госпитальной шкале тревоги и депрессии); подгруппа IIIа (nIIIа=19 человек; средний возраст 48±8,7 года) – больные с височно-долевой постинсультной эпилепсией, не имеющие достоверно выраженных симптомов тревоги (0–7 баллов по госпитальной шкале тревоги и депрессии); подгруппа IIIб (nIIIб=21 человек; средний возраст – 39±11,7 года) – больные с височно-долевой постинсультной эпилепсией с субклинически выраженной тревогой (8–10 баллов по госпитальной шкале тревоги и депрессии).
Критерии включения и невключения
Критерии включения в I (контрольную) группу:
– здоровые взрослые;
– правши;
– мужской и женский пол;
– возрастной период: первый период среднего
возраста (мужчины 22–35 лет; женщины 21–35 лет); второй период среднего возраста (мужчины 36–60 лет; женщины 36–55 лет);
– русскоговорящие европейцы;
– подписанное добровольное информированное согласие.
Критерии невключения в I (контрольную) группу:
– дети и подростки;
– левши;
– отказ от участия в настоящем исследовании;
– участие в других исследованиях;
– острые и хронические неврологические, психи-
атрические и эндокринологические заболевания на момент исследования;
– прием алкоголя (два стандартных «дринка» и более в течение последних 2 нед.);
– употребление наркотических препаратов на момент проведения исследования и в анамнезе.
Критерии включения во II, III (сопоставимые) группы:
– пациенты с постинсультной (лобной и височной) эпилепсией;
– мужской и женский пол;
– правши;
– возрастной период: первый период среднего
возраста (мужчины 22–35 лет; женщины 21–35 лет); второй период среднего возраста (мужчины 36–60 лет; женщины 36–55 лет);
– русскоговорящие европейцы;
– подписанное добровольное информированное согласие.
Критерии невключения во II, III (сопоставимые) группы:
– дети и подростки;
– левши;
– острыеихроническиеневрологические(кромепо-
стинсультной эпилепсии), психиатрические и эндокринологические заболевания на момент исследования;
– отказ от участия в настоящем исследовании;
– участие в других исследованиях;
– прием алкоголя (два стандартных «дринка»
и более в течение последних 2 нед);
– употребление наркотических препаратов на мо-
мент проведения исследования и в анамнезе.
Тестирование
Перед началом работы все участники исследования (I, II и III группы) проходили тестирование по госпитальной шкале тревоги и депрессии, которая представляла собой экспресс-скрининг. Шкала разработана A. Zigmond и R. Snaith в 1983 г. [14] для выявления и оценки тяжести депрессии и тревоги в условиях общемедицинской практики. Шкала обладает высокой дискриминантной валидностью в отношении двух расстройств: тревоги и депрессии. По результатам тестирования в каждой группе было выделено 2 подгруппы: подгруппа «а» – отсутствие достоверно выраженных симптомов тревоги и депрессии (0–7 баллов); подгруппа «б» – субклинически выраженная тревога (8–10 баллов).
Исследование кистевого теппинга
Исследование кистевого теппинга проведено с использованием авторской методики «Способ воздействия на индивидуальный ритм человека посредством экзогенной ритмической стимуляции» (патент РФ No 2015111025 от 20.10.2016 г.). Методика заключается в нанесении удара пальцем кисти по экрану оборудования – смартфону на базе ОС Android (рис. 2) – с удобной для испытуемого скоростью, в течение 1 мин. Программа позволяет регистрировать как временные параметры данного процесса (число ударов в минуту), так и глубину нажатия, а также равномерность всего цикла ударов [10,15]. Программа автоматически вычисляет среднюю, максимальную и минимальную частоту (в Гц); средний, максимальный и минимальный интервал от удара до удара (в секундах); глубину нажатия, процент стабильности ритма. В ходе изучения результатов кистевого теппинга были получены данные в виде общего списка интервалов между касаниями. Алгоритм разбивает общий список интервалов на три списка. Для каждого списка имеется среднее значение интервала (центроиды списка). Их разделение проходит таким образом, чтобы все интервалы в полученных списках были ближе к своим центроидам, чем к центроидам других списков. В первую очередь выбирались начальные значения для центроидов с помощью алгоритма k-means++. Следующим этапом итерационно вычислялись кластеры методом k-средних.
![Рисунок 2. Методика «Способ воздействия на индивидуальный ритм человека посредством экзогенной ритмической стимуляции» (патент РФ No 2015111025): А – общий вид исследования; В – пример результатов кистевого теппинга у здоровых волонтеров [10].](https://xn----7sbbpradbkcizg1dp3s.xn--p1ai/wp-content/uploads/2021/01/Snimok-e`krana-2021-01-12-v-00.57.03-300x230.png)
Рисунок 2. Методика «Способ воздействия
на индивидуальный ритм человека посредством экзогенной ритмической стимуляции» (патент РФ
No 2015111025): А – общий вид исследования; В – пример результатов кистевого теппинга у здоровых волонтеров [10].
За индивидуальный ритм была принята та частота, процент встречаемости которой был максимальным. Исследование проводили в утренние часы в условиях исключения внешних сенсорных раздражителей (громкий звук, яркий свет), присутствия других людей, кроме врача и пациента, во время проведения методики кистевого теппинга. Соблюдали температурный режим окружающей среды в диапазоне 22–25° С.
В процессе выполнения задания на экране прибора появляется механограмма, на которой вертикальными штрихами отображаются моменты соприкосновения пальца кисти с экраном оборудования. Мы анализировали следующие параметры: общее число ударов за 1 мин., среднюю частоту ударов в 1 с (Гц), стабильность – удельный вес частоты ударов, максимально приближенной к целевой частоте (в процентах), индивидуальный ритм – ритм, частота которого доминирует в выборке.
Этические аспекты
Проведение настоящего исследования одобрено локальным этическим комитетом КрасГМУ имени профессора В. Ф. Войно-Ясенецкого, Красноярск (протокол No77/2017 от 26.06.2017). Все участники перед началом исследования подписывали добровольное информированное согласие.
Здоровые добровольцы и больные с постинсультной эпилепсией не получали никакого вознаграждения за участие в настоящем исследовании. Исследователи не получали никакого вознаграждения за проведение настоящего исследования.
Методы статистического анализа
Статистическую обработку базы данных проводили с применением пакета прикладных программ Statistica, version 10 (StаtSoft, Inc, США). Для оценки статистической сопоставимости двух групп использовали критерий Манна-Уитни (р>0,05). Статистическую значимость определяли с помощью непараметрического критерия Вилкоксона (различия между группами считали статистически значимыми при р<0,05).
РЕЗУЛЬТАТЫ
Основные характеристики кистевого теппинга в I (контрольной) группе представлены в таблице 1.
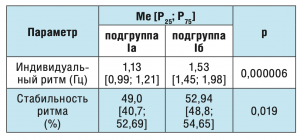
Таблица 1. Сравнение параметров кистевого теппинга у здоровых волонтеров без и с субликлинически выраженной тревогой.
Частота индивидуального ритма у здоровых волонтеров без тревоги (подгруппа Iа) была статистически значимо ниже по сравнению со здоровыми волонтерами аналогичного возраста с субклинически выраженной тревогой (подгруппа Iб) – 1,13 Гц и 1,53 Гц соответственно (р=0,000006). При этом наиболее стабильный ритм кистевого теппинга продемонстрировали обследуемые с тревогой (подгруппа Iб) по сравнению с обследуемыми без тревоги – 52,94 и 49,0% соответственно (р=0,019). Анализ полученных результатов свидетельствует о том, что нормативные параметры кистевого теппинга у здоровых взрослых и их клиническая интерпретация должны осуществляться с учетом психического состояния индивидуума на момент проведения исследования. При этом необходимо учитывать влияние даже субклинически выраженной тревоги на момент исследования, так как последняя влияет на количественные и качественные показатели кистевого теппинга (преимущественно на индивидуальный ритм и стабильность ритма) в норме.
Основные характеристики кистевого теппинга во II и III (сопоставимых) группах представлены в таблице 2.
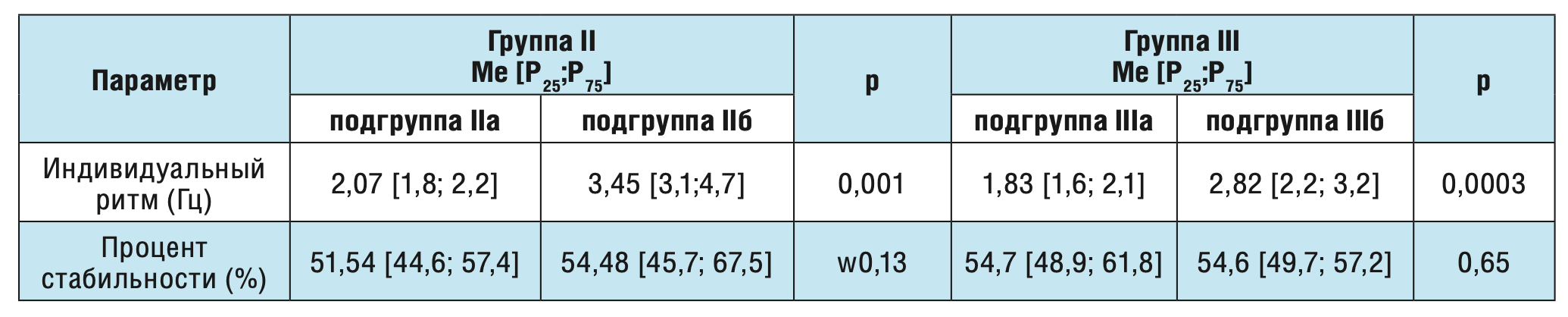
Таблица 2. Сравнение параметров кистевого теппинга у больных с лобно-долевой и височно-долевой постинсультной эпилепсиями.
В двух сопоставимых (II и III) группах наблюдения также отмечено статистически значимое нарастание частоты индивидуального ритма в зависимости от отсутствия или наличия субклинически выраженной тревоги – 2,07 Гц против 3,45 Гц (р=0,001) и 1,83 Гц против 2,82 Гц соответственно (р=0,0003). При этом стабильность ритма у обследуемых больных с постинсультной эпилепсией была высокой изначально и статистически значимо не менялась в зависимости от отсутствия/наличия субклинически выраженной тревоги.
Для оценки влияния локализации эпилептического очага на показатели кистевого теппинга проведено сопоставление данных показателей у пациентов с постинсультной лобно-долевой и височно-долевой эпилепсиями (II и III группы наблюдения), что представлено в таблице 3.

Таблица 3. Сравнительный анализ параметров кистевого теппинга в зависимости от локализации фокуса эпилептиформной активности у пациентов с постинсультной эпилепсией.
Нами показано, что индивидуальный ритм статистически значимо выше у пациентов с лобно-долевой локализацией эпилептического очага по сравнению с височно-долевой локализацией как у пациентов с субклинически выраженной тревогой (3,45 и 2,82 Гц соответственно, р=0,04), так и у пациентов без тревоги (2,07 и 1,83 Гц соответственно, р=0,035). Для выявления наличия/отсутствия влияния постинсультной эпилепсии на показатели кистевого теппинга проведено сравнение полученных данных в I, II и III группах обследуемых (табл. 4 и 5).
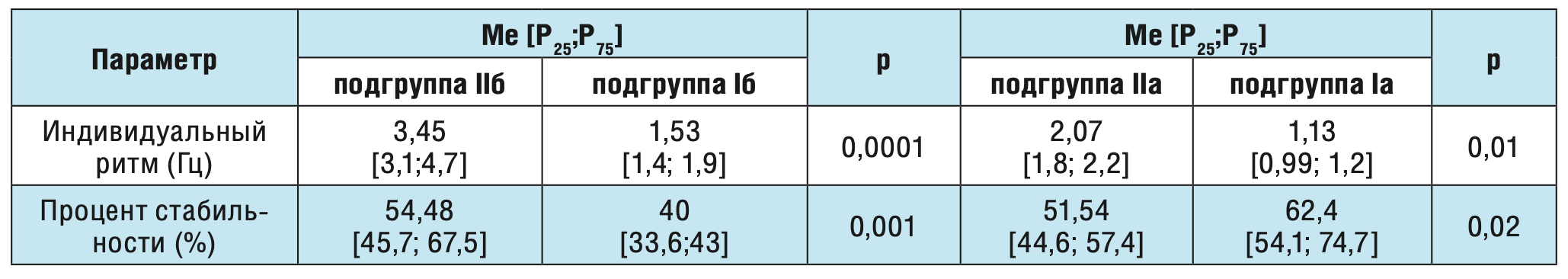
Таблица 4. Сравнение показателей кистевого теппинга у здоровых взрослых волонтеров и больных с постинсультной лобно-долевой эпилепсией в зависимости от уровня тревожности.
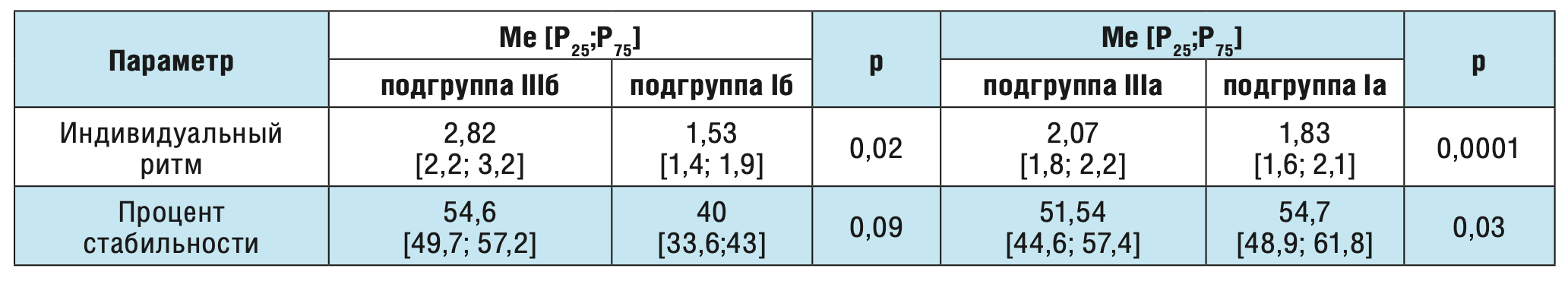
Таблица 5. Сравнение показателей кистевого теппинга у здоровых взрослых волонтеров и больных с постинсультной височно-долевой эпилепсией в зависимости от уровня тревожности.
Коэффициент ускорения индивидуального ритма у больных с постинсультной лобно-долевой и височно-долевой эпилепсиями был выше, чем у здоровых добровольцев (1,66 и 1,54 против 1,35 соответственно).
ОБСУЖДЕНИЕ
При сравнении основных параметров кистевого теппинга в контрольной и сопоставимых группах I , II и III (у индивидуумов с тревогой и без) отмечено статистически значимое увеличение показателя стабильности ритма у здоровых волонтеров по сравнению с группами больных с постинсультной эпилепсией. В то же время наличие субклинически выраженной тревоги прежде всего приводило к более выраженному нарастанию частоты индивидуального ритма (явление синхронизации) в подгруппах IIIб и IIб по сравнению с подгруппой Iб. Аналогичную ситуацию наблюдали и в подгруппах обследуемых без тревоги (подгруппы IIIа, IIа, Iа).
Показатель индивидуального ритма у пациентов, перенесших нарушение мозгового кровообращения в каротидном бассейне и не страдающих постинсультной эпилепсией, в проведенных нами ранее исследованиях [15] составил 1,36 Гц. Данный показатель более чем в 1,5 раза меньше показателя пациентов с наличием постинсультной эпилепсии.
Таким образом, тревога, повышающая синхронизацию «внутреннего» ритма и отражающаяся на характеристиках кистевого теппинга, у больных с постинсультной эпилепсией нуждается в коррекции. Авторы предполагают, что снижение степени синхронизации «внутреннего» ритма у взрослых со структурной (постинсультной, постоперационной) эпилепсией, может быть достигнуто не только с помощью фармакотерапии, но и с помощью немедикаментозных методов, включая персонализированный подход к выбору индивидуального для каждого пациента ритма кистевого теппинга, позволяющего предупредить ускорение частоты индивидуального «внутреннего» ритма и повысить стабильность исходно более медленных ритмов на стадии ауры и фокальных эпилептических приступов без нарушения осознания, снижая тем самым риск развития более тяжелых фокальных приступов с вторичной билатеральной трансформацией и/или серийных фокальных эпилептических приступов с нарушением осознания. Данная гипотеза нуждается в проверке в рамках дальнейших клинических исследований.
ЗАКЛЮЧЕНИЕ
Изучение влияния уровня тревоги на параметры кистевого теппинга у здоровых взрослых и больных с постинсультной эпилепсией с использованием модифицированной авторской методики «Способ воздействия на индивидуальный ритм человека посредством экзогенной ритмической стимуляции» позволило выявить некоторые общие тенденции. Так, при наличии субклинически выраженной тревоги происходит ускорение индивидуального ритма как у здоровых добровольцев, так и у больных с постинсультной эпилепсией. Однако коэффициент ускорения внутреннего ритма у больных с постинсультной эпилепсией выше, чем у здоровых.
Найдена также зависимость показателей индивидуального ритма от локализации эпилептического очага. Так, у пациентов с лобно-долевой эпилепсией показатель индивидуального ритма выше, чем при височно-долевой локализации. Вероятно, это связано с близостью моторной зоны в лобной доле головного мозга. Кроме того, некоторые авторы указывают на наличие своеобразного метронома в префронтальной коре [16].
Однако данная закономерность становится достоверной при присоединении тревожного компонента к основному заболеванию. Так, у пациентов с постинсультной лобно-долевой и височно-долевой эпилепсиями без тревоги статистически значимой межгрупповой разницы между показателями индивидуального ритма не наблюдается, хотя эти показатели были значительно выше, чем у здоровых взрослых. Это, вероятно, связано с наличием структурных повреждений головного мозга у пациентов, перенесших инсульт.
Таким образом, параметры кистевого теппинга у пациентов с постинсультной эпилепсией, а также клиническая интерпретация полученных результатов должны осуществляться с учетом психического состояния индивидуума на момент проведения исследования и при подборе индивидуального ритма кистевого теппинга для профилактики фокальных эпилептических приступов с нарушением сознания и вторичной билатеральной трансформацией при фокальной постинсультной эпилепсии.
